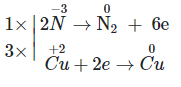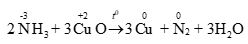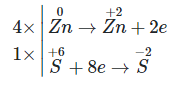Đề thi thử giữa học kỳ 2 môn Hoá Học lớp 10 online - Mã đề 06
Vui lòng cài đặt đề thi trước khi làm bài
Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
Trong hợp chất H2S, số oxi hóa của sulfur (lưu huỳnh) là
Nhận xét nào sau đây về số oxi hoá là không đúng?
Số oxi hóa của nitrogen trong NO3- là
Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
Số oxi hoá của Al trong NaAlH4 là
Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
Trong các phản ứng hoá học sau, phản ứng oxi hoá – khử là
Nhóm nào sau đây gồm các chất vừa có tính oxi hoá, vừa có tính khử?
Trong phản ứng tạo thành magnesium chloride từ đơn chất: Mg + Cl2 → MgCl2. Kết luận nào sau đây đúng?
Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
NH3 + CuO → Cu + N2 + H2O
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là
Cho phương trình hóa học:
aZn + bH2SO4 (đặc) → cZnSO4 + dH2S + fH2O.
Giá trị của b trong phương trình hóa học trên là
Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) thu được là (coi NO là sản phẩm khử duy nhất)
Cho các phản ứng sau:
(1) Phản ứng trung hoà acid – base: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
Phát biểu nào sau đây không đúng?
Ở điều kiện chuẩn. Khi phản ứng thu nhiệt thì
Enthalpy tạo thành chuẩn của một đơn chất bền là
Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + O2 (g) ⟶ CO2 (g) ${\Delta _r}H_{298}^0 = - 283,0kJ$
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) ⟶ P (s, trắng) ${\Delta _r}H_{298}^o = 17,6kJ$
Điều này chứng tỏ phản ứng:
Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) ${\Delta _r}H_{298}^o$ = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có ${\Delta _r}H_{298}^o$ tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng trung bình các liên kết trong các chất cho trong bảng sau:
Liên kết | Eb (kJ/mol) | Liên kết | Eb (kJ/mol) |
C=C | 612 | C-C | 346 |
C-H | 418 | H-H | 436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
Cho phản ứng sau:
$CO\left( g \right) + C{l_2}\left( g \right)\mathop \to \limits^{than\,hoat\,tinh} COC{l_2}\left( g \right)\,{\Delta _r}H_{298}^o\, = \, - 105\,kJ$
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol. Giá trị Eb(C ≡ O) là
Phát biểu nào sau đây về nhiệt tạo thành là không đúng?
Điều kiện nào sau đây không phải là điều kiện chuẩn?
Quy tắc xác định số oxi hoá nào sau đây là không đúng?
Cho các hợp chất sau: FeO; FeCl2; Fe(OH)3; Fe2O3; FeSO4. Số hợp chất trong đó sắt có số oxi hoá +2 là

.png)