Đề thi thử giữa học kỳ 1 môn Hoá Học lớp 10 online - Mã đề 07
Vui lòng cài đặt đề thi trước khi làm bài
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng
Số hiệu nguyên tử của nguyên tố Na bằng 11, trong một nguyên tử Na có bao nhiêu electron?
Nhóm A bao gồm các
Có bao nhiêu electron tối đa ở lớp thứ 3 (lớp M) ?
Ở trạng thái cơ bản cấu hình electron nguyên tử nào sau đây là của phi kim?
Số electron tối đa trong phân lớp d là
Hạt nhân nguyên tử được cấu tạo bởi hầu hết các hạt
Nguyên tố nào sau đây thuộc khối nguyên tố s?
Cấu hình electron của Ca (Z=20) là
Cấu hình electron của calcium (Z=20) là
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p6. Số hiệu nguyên tử của X là
Nguyên tố boron có 2 đồng vị: ${}_5^{10}B$ chiếm 18,89% số nguyên tử và ${}_5^{11}B$ chiếm 81,11% só nguyên tử. Nguyên tử khối trung bình của boron là
Nguyên tử R có phân mức năng lượng cao nhất (ở trạng thái cơ bản) là 2p4. Tổng số hạt mang điện trong nguyên tử R là
Biết nguyên tử Na có kí hiệu nguyên tử là ${}_{11}^{23}Na$, vậy tổng số hạt p, n, e trong ion Na+ là
Nguyên tử nguyên tố X (Z = 12) có cấu hình electron là
Nguyên tử Z có 9 proton và 10 neutron. Nguyên tử Y có 10 proton và 10neutron. Phát biểu nào dưới đây về X và Y là đúng?
Nguyên tố X thuộc chu kì 4, nhóm IIIA. Cấu hình electron của nguyên tử X là
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số elctron độc thân của M là
Chọn câu phát biểu sai?
1. Trong nguyên tử luôn có số proton bằng số elctron bằng điện tích hạt nhân
2. Tổng số proton và số electron trong một hạt nhân gọi là số khối
3. Số khối A là khối lượng tuyệt đối của nguyên tử
4. Đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số hạt proton nhưng khác nhau số hạt neutron.
Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hóa học nào sau đây
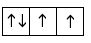
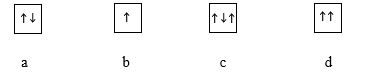
Hình vẽ nào sau đây vi phạm nguyên lý Pauli khi điền electron vào orbital (AO)?
Kết luận nào sau đây luôn luôn đúng
Cho các nguyên tố: K (Z=19), O (Z=8), Al (Z=13), P (Z=15). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải
Neon (Z=10) tách ta từ không khí là hỗn hợp của hai đồng vị với % về số nguyên tử tường ứng là 20Ne (91%) và 22Ne (9%). Nguyên tử khối trung bình của Ne là
Nguyên tử F có 9 proton, 9 electron và 10 notron. Số khối của nguyên tử F là
Nguyên tử của nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không mang điện là 22 hạt. Số proton và số khối của nguyên tử X là
Nguyên tử khối trung bình của bromine là 79,91. Bromine có hai đồng vị ${}_{35}^{79}Br$chiếm 54,5%. Vậy số khối của đồng vị thứ 2 là
Tổng số hạt p, n, e trong một nguyên tử ${}_{13}^{27}Al$ là
Vị trí của nguyên tố có cấu hình electron nguyên tử 1s22s22p63s23p5 trong bảng tuần hoàn là
Số electron tối đa có trong phân lớp s là
Cấu hình eletron nguyên tử có Z = 13 là 1s22s22p63s23p1. Phát biểu nào sau đây sai
Nguyên tố X thuộc nhóm IVA. Số electron lớp ngoài cùng của X là
Cation R2+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Vị trí của R trong Bảng tuần hoàn là
Một nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electron là 52 và có số khối là 35. Số hiệu nguyên tử của nguyên tố X là
Cấu hình electron nào sau đây là của nguyên tố kim loại
Nguyên tử nào sau đây có 4 electron thuộc lớp ngoài cùng
Cấu hình electron nào sau đây viết không đúng?
Dãy nào dưới đây gồm các đồng vị của cùng một nguyên tố hóa học?
Nguyên tử X có tổng số hạt proton, neutron, electron là 34. Biết số neutron nhiều hơn số proton là 1. Số khối của nguyên tử X là
Nguyên tử X có 3 lớp electron, trong đó lớp ngoài cùng có chứa 5 electron. X có điện tích hạt nhân là